Celyad au plus haut historique sur Euronext, en attendant le Nasdaq
Le titre Celyad se hissait à un nouveau sommet en Bourse à plus de 63 euros mardi 19 mai.
Au tour de Celyad de frapper à l’huis de Wall Street. Dans le sillage de Galapagos, qui vient de réussir la plus importante IPO jamais réalisée par une biotech européenne au Nasdaq, et des français DBV Technologies et Cellectis, la société belge (officiellement renommée Celyad depuis le début du mois) a déposé le 18 mai auprès du gendarme américain des marchés financiers son document d’enregistrement. C’est le véritable coup d’envoi du processus de cotation outre-Atlantique. L’ex-Cardio3 BioSciences avait initialement fait part du projet en avril dernier.
Quatrième séance de hausse consécutive avec un gain de plus de 10 % mardi pour l’action Celyad sur Euronext, et un nouveau plus haut historique à la clé (soit près de 280 % de gains par rapport au prix d’introduction de 16,65 euros en juillet 2013). Le marché ne doute guère du succès du projet d’introduction à Wall Street, d’autant que le groupe brabançon a un double avantage à faire valoir. La société spécialisée dans les thérapies cellulaires peut compter primo sur l’engouement non démenti des investisseurs anglo-saxons pour les biotechs européennes (le record de 275 millions de dollars levé par le belge Galapagos il y a quelques jours montre que cette tendance est toujours intacte) et secundo sur l’intérêt envers les entreprises développant des immunothérapies de type CAR T (chimeric antigen receptor T cells).
Pour le moment la société de Mont-Saint-Guibert entre en période de black-out et ne peut donner d’indications quant au nombre d’ADS (American Depositary Share) qu’elle pourrait émettre et au montant des fonds qu’elle compte obtenir. L’idée est maintenant de laisser les investisseurs examiner à tête reposée le fameux formulaire « F-1 » qui présente la société et ses principaux facteurs de risque. Le F-1 de Celyad est consultable sur le site de la Securities and Exchange Commission. Après 21 jours la direction pourra présenter son argumentaire d’investissement lors du traditionnel roadshow.
Le groupe dirigé par Christian Homsy précise tout de même les principaux objectifs de son projet. Les programmes en matière d'insuffisance cardiaque, notamment la mise au point de C-Cure actuellement en phase III d’essais cliniques dans le traitement de l’insuffisance cardiaque ischémique, étant intégralement financés, le produit de l’introduction à Wall Street sera affecté à :
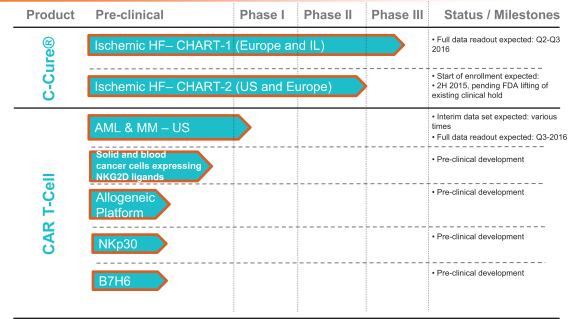
• la poursuite du développement de NKG2D CAR T-cell au travers de l’étude clinique de phase I dans la leucémie myéloïde aiguë et le myélome multiple ;
• au développement de nouveaux produits candidats de thérapies fondées sur les cellules CAR T, pour le traitement de nouveaux cancers du sang et des tumeurs solides ;
• au renforcement des fonctions générales, administratives et opérationnelles en Belgique ainsi qu’aux États-Unis (création d’une nouvelle unité à Rochester etc.)
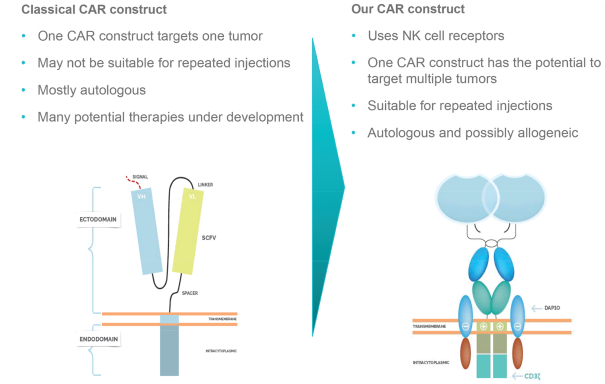
Celyad est convaincu que son approche des thérapies CAR-T peut aboutir à traiter un éventail de cancers plus large que les autres thérapies de CAR T qui ciblent l'antigène CD19. Sur le segment des CAR T les principaux concurrents de Celyad sont aujourd'hui Bellicum Pharmaceuticals, bluebierd bi., Cellectis, Juno Therapeutics, Kite Pharma et Ziopharm Oncology, ainsi que le suisse Novartis.
Son principal candidat, CAR-NKG2D, a donné lieu à des données prometteuses dans des modèles animaux cancéreux, notamment pour le traitement du lymphome, du cancer de l'ovaire et du myélome. CAR-NKG2D s’articule autour de récepteurs de cellules NK (Natural Killers, cellules tueuses de tumeurs de notre système immunitaire) en ciblant les ligands présents dans de nombreuses cellules cancéreuses. « En conséquence, notre technologie a le potentiel d'attaquer et de tuer un large éventail de cancers solides et sanguins, tandis que la thérapie CAR CD19 est généralement seulement efficace dans le traitement des tumeurs malignes à lymphocytes B ».
Dans les essais précliniques, la survie des rongeurs affectés a spectaculaire progressé après traitement par CAR-NKG2D : jusqu'à 100 % des souris traitées survivantes (jusqu'à 325 jours de suivi). Désormais Celyad a démarré le premier essai pour tester la sécurité et la faisabilité chez l’homme d'une injection unique de CAR-NKG2D sans lymphodéplétion préalable. Les données complètes de cet essai mené au Dana-Farber Cancer Institute (Harvard Medical School) devraient être publiées à la mi-2016, avec des données intérimaires dans l’intervalle.
Dans l’insuffisance cardiaque, la société poursuit le développement de C-Cure en espérant obtenir prochainement la levée de la suspension de la FDA. Le recrutement de l’essai européen CHART-1 s’est terminé en mars et les résultats complets devraient être publiés mi 2016 (interimaires au 3e trimestre 2015). L’essai de phase III mené aux USA, CHART-2, pourrait débuter au second semestre 2015, si l’autorité américaine lève la suspension comme l’espère Celyad. Rappelons qu’à l’origine, c’est-à-dire en 2012, la société avait monté le dossier de l’étude en projetant d’utiliser le cathéter Myostar de Cordis. Puis la mise au point de son propre matériel, C-Cath, beaucoup plus innovant, l’a incité à demander à la FDA l'autorisation de changer le protocole initial. Mais cela a amené l’agence à suspendre l'étude (clinical hold) en sollicitant des précisions sur ce nouveau matériel et, au passage, en demandant que soient jointes les premières données de sécurité de CHART-1.
Pipeline complet de Celyad à mai 2015 :