L’ANSM suspend la production du site pilote de TxCell, l’action chute
L'action TxCell subissait mercredi en séance sa plus forte chute (perdant jusqu'à 14,67 %) depuis son introduction au compartiment C en avril 2014, à l'annonce de la suspension d'une partie de la production sur son site pilote. L’ANSM (Agence Nationale de Sécurité du Médicament) a en effet identifié un défaut de conformité aux BPF, en l'occurrence un risque de contamination microbienne. Il s'agit seulement d'un problème normatif, aucune contamination effective n'ayant eu lieu. Les lots du traitement Ovasave produits sur le site à destination de l’étude CATS29 (un essai de phase 2b pour le traitement de la maladie de Crohn réfractaire) devraient continuer à être administrés aux patients selon le protocole de l’étude, sous réserve de l'accord de l'ANSM.
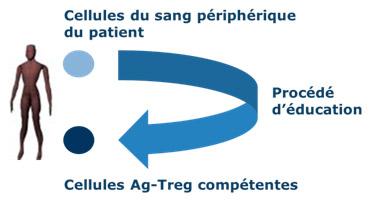
Le site de production pilote installé à Besançon permet de fabriquer le traitement à partir des propres cellules du patient puisque Ovasave se base sur les propriétés de lymphocytes T régulateurs autologues. L'autorisation de produire a été obtenue le 23 septembre 2013 et un certificat BPF (bonnes pratiques de fabrication) délivré le 10 juin 2014. La vocation du site est en tout état de cause temporaire puisque TxCell a l’intention de basculer l’ensemble de sa production vers un site de production commerciale d’ici la fin de l’année 2018.
"La décision de recourir à un sous-traitant afin d’accélérer la production des lots cliniques entre 2016 et 2018 ayant déjà été prise, cette suspension partielle ne devrait avoir qu’un impact limité sur les délais annoncés au mois de mai sur les développements cliniques en cours et, plus généralement, aucun impact sur le plan de marche de TxCell à long terme", a expliqué Stéphane Boissel, le nouveau Directeur Général de TxCell. "Nous travaillons en très étroite collaboration avec l’ANSM afin de nous assurer que tout risque potentiel sur le site de Besançon sera adressé et de pouvoir reprendre une activité de production normale d’ici la fin de l’année", a-t-il précisé, en soulignant bien qu'il n'était survenue aucun problème de sécurité lié à la production depuis le début de l’étude CATS29 actuellement en cours.
La production de nouveaux lots sera suspendue jusqu’à ce que la conformité soit assurée, ce que TxCell prévoit pour la fin de l’été. TxCell devra alors redémontrer sa conformité aux BPF, ce qu’elle entend faire d’ici la fin de l’année en cours.
Les premiers résultats de cette phase 2b CATS29 sont en principe attendus entre la fin 2016 et début 2017. Le marché sanctionne avant tout un potentiel retard, qui sera fonction de la rapidité avec laquelle l'entreprise parvient à rassurer l'ANSM, et du volume de lots déjà produits.
La plate-forme de TxCell permet à partir d'un simple échantillon sanguin du patient de produire en masse des cellules Treg de type 1 aux propriétés anti-inflammatoires, en plusieurs doses permettant théoriquement de traiter un patient pendant plusieurs années. Ces cellules thérapeutiques sont ensuite stockées congelées pour être administrées par injection au fil de la durée du traitement.
Pour cela toutefois, l'ANSM doit encore donner son feu vert en fonction d'une analyse des risques. Dans l'attente de la levée de ces conditions, l'action TxCell est donc sanctionnée d'autant plus durement que le titre figurait dans le peloton des micro-capitalisations du secteur qui s'était brusquement envolé ces dernières semaines (jusqu'à +85 % de gains en quelques séances).