Des changements à la FDA portent les espoirs des investisseurs
Après une chute des approbations FDA en 2016, la future nomination du nouveau directeur de l'agence (qui s'est prononcé pour un assouplisssement des autorisations de mise sur le marché de nouveaux médicaments) porte les espoirs des investisseurs.
Approbations FDA de nouveaux médicaments : chute en 2016
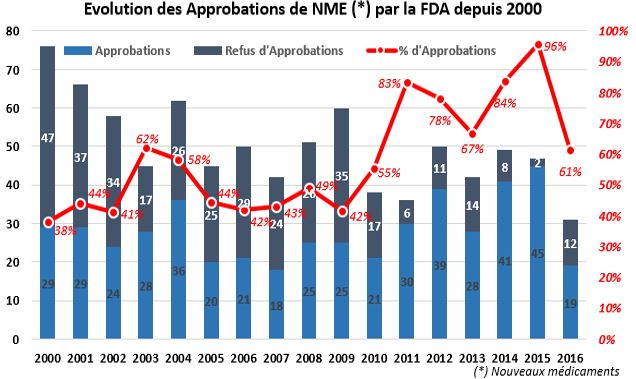
En 2015, la FDA a approuvé pas moins de 45 nouveaux médicaments. Un chiffre jamais vu depuis 1996. En 2016, ce nombre a été divisé par plus de 2, pour atteindre seulement 19 nouveaux médicaments (source). Nous précisons que les «nouveaux» médicaments (NME, pour ‘New Medical Entity’) ne font référence qu'à de véritables nouvelles thérapies et n'incluent pas, par exemple, un médicament anticancéreux déjà approuvé pour le traitement du mélanome, puis une indication supplémentaire. Ceci ne tient compte également que d’une seule dose. Si on remonte à une décennie, la FDA était critiquée pour ne pas approuver assez de nouveaux médicaments. A partir de 2015, certains critiques faisaient valoir qu’elle approuvait trop de traitements (qui n'étaient pas nécessairement efficace). Si bien que nous avons assisté à une chute des approbations en 2016, ce qui avait pénalisé le secteur dans son ensemble.
Evolution des Approbations FDA et du % d’approbation (2000-2016) :
 Source Graphique : BiotechBourse
Source Graphique : BiotechBourse
Comme on peut le voir sur notre graphique, de 2011 à 2015, la FDA a considérablement accéléré son rythme d'approbations de médicaments, avec 36 nouveaux médicaments approuvés par an en moyenne. C’est principalement ce qui a alimenté le Bull Market du Nasdaq Biotech. En 2016, seuls 19 médicaments ont été approuvés - il faut remonter à 2007 pour trouver moins de 20 approbations. On peutx expliquer la baisse des approbations FDA de 2016 de trois façons :
1) Il y a eu 5 demandes d’approbations qui devaient être traitées par la FDA en 2016, mais qui ont été approuvées en 2015.
2) Les Biotechs ont déposé moins de demandes de nouveaux médicaments : on a eu 31 soumissions en 2016, contre 47 en 2015.
3) La FDA a aussi annoncé plus de refus d’approbations (qui explique en partie le taux d’approbation de 61%), citant des soucis de fabrication dans les usines de développement (ex. : Nicox)
Le choix du nouveau Directeur de la FDA validerait une dérégulation des approbations
Plus tôt cette année, le Congrès (via le ‘21st Century Cures Act’) et les groupes d'intérêts (défenseurs des patients et grandes entreprises pharmaceutiques) se sont prononcés pour une accélération du processus d'approbation – surtout pour les besoins médicaux non satisfaits. Il est donc d’ores et déjà établi, sur le plan politique, qu’il y aura plus de souplesse de la part de la FDA lors des prochaines années.
Déjà en début d’année, on évoquait les noms de Gottlieb et d’O’neill qui sont pour favoriser l’innovation (surtout Mr O’neill, bras droit de Peter Thiel, un investisseur de la Silicon Valley qui a suggéré que les médicaments doivent être autorisés une fois que la sécurité des produits a été confirmée). Mais O’neill ne disposait pas de diplôme de Docteur, ce qui n’est pas le cas de Gottlieb (il a été diplômé à la Mount Sinai School of Medicine en 1999).
Donald Trump, peu après son investiture, s’était déjà prononcé pour favoriser les approbations de nouveaux médicaments. Dans son plan d'action pour les 100 premiers jours de son mandat (source), il a déclaré: « Les réformes comprendront la réduction des formalités administratives à la FDA. Il y a plus de 4 000 médicaments en attente d'approbation et nous voulons surtout accélérer l'approbation des médicaments qui sauvent des vies ».
Scott Gottlieb, ancien commissaire adjoint de la FDA sous George W. Bush, a été confirmé en tant que choix de Donald Trump pour diriger l'agence, selon une déclaration officielle provenant de la Maison Blanche. Il a été le choix préféré de l'industrie pharmaceutique pour le poste de la FDA et a travaillé comme consultant auprès de certaines de ses sociétés. Avant de devenir officiellement directeur de la FDA, Gottlieb doit être confirmé par le Sénat.
Depuis sa sortie de la FDA, Gottlieb a travaillé comme conseiller auprès d'entreprises d'investissement et comme membre de l'American Enterprise Institute, un groupe de réflexion conservateur de Washington. Gottlieb a également travaillé au Centers for Medicare et Medicaid Services, où il a aidé à mettre en œuvre le programme Medicare Part D qui a fourni une couverture aux personnes âgées. Ces dernières années, Gottlieb a été est associé chez New Enterprise Associates, l'une des plus importantes sociétés de capital-risque au monde, qui possède un portefeuille de plus de 300 entreprises dans les secteurs de la technologie et de la santé.
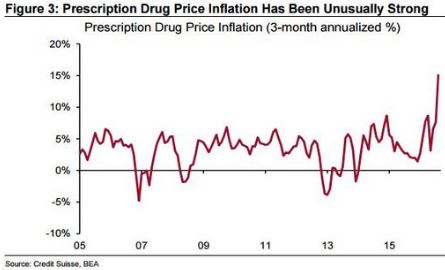
Gottlieb est favorable à une réduction du coût des médicaments, en accélérant notamment la concurrence des génériques moins chers sur le marché. A priori, cette disposition n’impactera pas les Biotechs, puisque les produits biologiques sont difficiles à copier. Et d’autre part leur protection de brevets s’étale sur une longue période 15 à 20 ans). Mais il semble que le problème des prix des médicaments, vrai sujet si on se réfère à l'envolée de l'inflation, puisse être 'auto-régulé' : en accordant plus d'approbations, la concurrence fera baisser les prix. C'est en tous cas ce qu'estiment les investisseurs.
Evolution de l'inflation du prix des médicaments aux US (2005-2016, en moyenne trimestrielle) :
Source Graphique : Credit Suisse
Attendons maintenant de voir si le Sénat enterinera la nomination de Gottlieb. Une confirmation à ce poste marquera, à n'en pas douter, un retour de l'optimisme. Les dispositions qui seront prises pourraient continuer de favoriser le secteur et impacter favorablement le moral des investisseurs, après les questionnements apparus ces derniers temps.