Nouvelle indication orpheline pour l’inécalcitol, Hybrigenics prépare une phase 2 supplémentaire
Et de deux. La molécule phare d’Hybrigenics, l’inécalcitol, a décroché l’avis favorable du comité des produits pharmaceutiques orphelins de l’Agence Européenne du Médicament dans la leucémie myéloïde aiguë (LMA, deuxième forme de leucémie par la fréquence et celle pour laquelle le taux de survie à cinq ans est le plus faible). Il s’agira de la deuxième désignation de médicament orphelin pour la molécule, un agoniste des récepteurs de la vitamine D, après celle obtenue en 2014 dans la leucémie lymphoïde chronique (LLC).
Dès lors, Hybrigenics prépare une étude clinique de phase 2 supplémentaire de l’inécalcitol, en association avec l’azacytidine ou la décitabine (deux anticancéreux déjà utilisés chez les patients qui ne supporteraient pas la chimiothérapie standard) chez les patients fragiles ou âgés atteints de LMA, aussi bien en France qu’aux Etats-Unis, a expliqué le Docteur Jean-François Dufour-Lamartinie, directeur R&D clinique de la société.
Au total, ce sera la troisième phase 2 sur l’inécalitol. Dans le cancer de la prostate hormono-résistant, un essai chez 54 patients a montré une forte présomption d'efficacité pour l’emploi de l'inécalcitol en association avec le Taxotère : 85 % des patients qui ont vu leurs taux de PSA diminuer d'au moins 30 % durant les 3 premiers mois du traitement contre 67 % des patients habituellement pour le Taxotère seul. Dans la LLC, l’essai d’efficacité est en cours. Il vise à traiter 54 patients déjà sous traitement par imatinib (Glivec) depuis plus de deux ans, mais présentant encore une maladie résiduelle attestée par le biomarqueur sanguin spécifique de la LMC, appelé BCR-ABL.
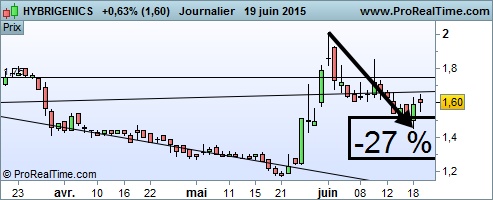
Après avoir corrigé de 27 % en quinze jours début juin, l’action Hybrigenics profitait de cette nouvelle désignation orpheline pour rebondir de près de 10 % à 1,75 euro lundi matin.
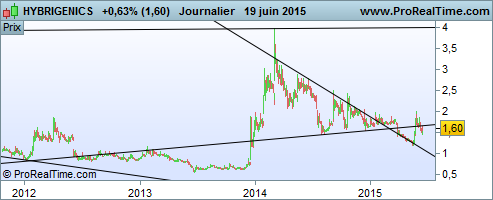
Sur long terme, on observe que l'action est en position de franchir à la hausse un ancien support :
Les médicaments orphelins peuvent bénéficier d’une exclusivité commerciale de dix ans dans la Communauté Européenne consécutivement à l’AMM, d'un accès direct à la procédure centralisée d’autorisation de mise sur le marché passant par l’EMEA, de possibles exonérations de redevances (dispense de frais de dossier d'AMM par exemple) et d'un accès à des crédits dans le cadre de programmes nationaux et/ou européens en faveur de la recherche et du développement.